上海金畔生物科技有限公司代理日本同仁化学试剂盒全线产品,欢迎访问日本同仁化学dojindo官网了解更多信息。
 –Cellstain®– PI solution
–Cellstain®– PI solution
–Cellstain®– PI solution
- 分子生物学関連試薬
- 細胞染色用色素
死細胞染色色素
-
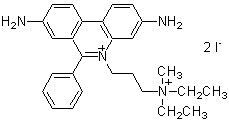
製品コードP378 –Cellstain®– PI solution
-
CAS番号25535-16-4(PI)
-
化学名3,8-Diamino-5-[3-(diethylmethylammonio)propyl]-6-phenylphenanthridinium diiodide, solution
-
分子式・分子量C27H34I2N4=668.39
| 容 量 | メーカー希望 小売価格 |
富士フイルム 和光純薬 |
|---|---|---|
| 1 ml | ¥6,000 | 341-07881 |
- ご購入方法
- お問い合わせ
マニュアル
-
プロトコル
 細胞を染色したい
細胞を染色したい 
-
パンフレット
 細胞増殖測定 細胞染色プロトコル
細胞増殖測定 細胞染色プロトコル 
参考文献
1) I. W. Taylor and B. K. Milthorpe, "An Evaluation of DNA Fluochromes, Staining Techniques, and Analysis for Flow Cytometry. I. Unperturebed Cellpopulations", J. Histochem. Cytochem., 1980, 28(11), 1224.
2) W. M. J. Vuist, F. V. Buitenen, M. A. De Rie, A. Hekman, P. Ruemke and C. J. M. Melief, "Potentiation by Interleukin 2 of Burkitt's Lymphoma Therapy with Anti-Pan B (Anti-CD19) Monoclonal Antibodies in a Mouse Xenotransplantation Model", Cancer Res., 1989, 49, 3783.
3) A. K. El-Naggar, J. G. Batsakis, K. Teague, L. Garnsey and B. Barlogie, "Single- and Double-stranded RNA Measurements by Flow Cytometry in Solid Neoplasms", Cytometry, 1991, 12, 330.
4) C. Souchier, M. Ffrench, M. Benchaib, R. Catallo and P. A. Bryon, "Methods for Cell Proloferation Analysis by Fluorescent Image Cytometry", Cytometry, 1995, 20, 203.
5)T. Yamazaki, H. Suzuki, S. Yamada, K. Ohshio, M. Sugamata, T. Yamada and Y. Morita, "Lactobacillus paracasei KW3110 Suppresses Inflammatory Stress-Induced Premature Cellular Senescence of Human Retinal Pigment Epithelium Cells and Reduces Ocular Disorders in Healthy Humans”, Int J Mol Sci, 2020, 21(14), 5091
よくある質問
-
Q
核染色剤に使用される色素の特徴、違いは何でしょうか?
-
A
ここで紹介している色素は核酸との相互作用により蛍光を発するか、蛍光強度が強くなる特徴があります。
蛍光波長以外の違いとしては下記の点がございます。【EB】
塩基特異性は無く、全DNA,RNAに結合します。
生細胞の膜透過性がなく、死細胞を染色します。【PI】
EBと同様に塩基特異性はありません。インターカレーションした時の蛍光強度が
EBより高いため、より広く使用される色素です。
生細胞の膜透過性がなく、死細胞を染色します。【DAPI】
2重鎖の副溝(minor groove)と結合します。アデニン-チミジンクラスターに高い結合性を持っています。
生細胞の膜透過性がなく、死細胞を染色します。【AO】
2重鎖にインターカレーションしたときと、単鎖のリン酸に結合した時では蛍光波長が異なることを
利用して、2重鎖と単鎖を区別して検出できます。
生細胞の細胞膜を透過します。【Hoechst33342、33258】
DNAのアデニン-チミジン部に特異的に結合します。
生細胞の細胞膜を透過し、生細胞のDNAを染色できる色素です。
-
Q
細胞染色色素の励起と蛍光の波長を教えて下さい。
-
A
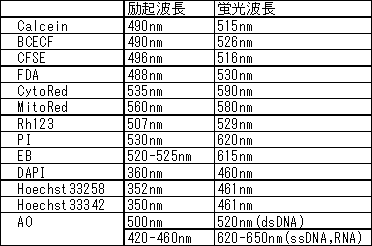
*AOはフローサイトメトリーなどでは488 nm励起で観察されることもあります
-
Q
固定化後に染色すると、核が染まらないのですが何か対策はありますか?
-
A
固定化および膜透過処理の条件によっては核が染まらないことがあります。
その際は、処理条件をご検討頂く必要があります。なお、PFA(パラホルムアルデヒド)固定化処理を長時間することで、核が染まらない事例がございます。
下記、弊社での事例を参考に固定化および膜透過処理の条件をご検討ください。○PIで核を染色できた処理条件
使用細胞 : HeLa細胞
固定化処理:4% PFA/PBSにて5分間インキュベート
膜透過処理:1% Triton X-100/PBSにて20分間インキュベート上記処理後に、PI solution 30 μg/mLにて染色して観察
○PI染色後、核が染まらない結果となった条件
使用細胞 : HeLa細胞
固定化処理:2% PFA/PBSにて60分間インキュベート
膜透過処理:1% NP-40/PBSにて60分間インキュベート上記処理後に、PI solution 30 μg/mLにて染色して観察
-
Q
PIの使用方法を教えてください。
-
A
下記に例を示します。細胞の種類、観察条件により細胞の固定や試薬濃度を検討してください。
【使用例①】
Vollenweiderらはリンフォカイン活性化キラー(LAK)細胞の増殖アッセイにおいて、PI染色を行い、蛍光プレートリーダーを用いて測定している。
その時の濃度はストック溶液で 0.5 mg/mL PBS(-) 。使用濃度は 5 μg/mL クエン酸ナトリウム溶液を用い、1well当たり100μL使用して蛍光染色している。
・I.Vollenweider, P.Groscurth, J.Immunol.Methods, 149, 133(1992).【使用例②】
(1) 固形腫瘍あるいはcluster を含むサンプルについては、0.02% tripsin EDTAにて処理。
37℃にて30分間インキュベート後、1500rpmで5分間行い、上清を捨てる。
(2) -20℃の50% メタノールにて固定後、1500rpmで5分間行い、上清を捨てる。
(3) -20℃の30% メタノールにて洗浄後、1500rpmで5分間行い、上清を捨てる。
(4) 0.2 mol/L phosphate buffer(pH7.2)にて洗浄後、1500rpmで5分間行い、上清を捨てる。
(5) RNaseの0.2 mol/L phosphate buffer(pH7.2)溶液(1 mg/mL)を細胞106個あたり
0.2 mL加え、37℃にて30分間インキュベートする。
(6) 0.2 mol/L phosphate にて洗浄後、1500rpmで5分間行い、上清を捨てる。
(7) PI溶液(50 μg/mL)を10mL加え、4℃にて2時間、遮光の上染色を行う。
・”フローサイトメトリー入門”より、医学書院発行
-
Q
EBやPIを使用した際の廃棄物があります。処理はどのようにすればよいですか?
-
A
*施設によりガイドラインが定められている場合があります。ガイドラインがある場合にはそれに従って下さい。
廃液は排水処理設備がある場合には、排水として流してください。下記方法により分解して、廃水処理すればより安全です。
・UV照射や日光にさらし分解する。
・次亜塩素酸ナトリウム等により酸化分解する。処理設備がない場合、分解し、廃水を貯めておいて処理業者に依頼してください。
染色したゲルなどは乾燥して、焼却処分してください。


取扱条件
| 性状: | 本品は、橙色~赤色液体の凍結品である。 |
|---|---|
| 含量: | 試験適合 |
| 1.保存方法:冷凍,遮光 |


